Producto 1: Mapa
conceptual de la teoría atomica
Producto
2: Vida y teoría de Lewis
Gilbert
Newton Lewis
Tuvo educación
hogareña hasta esa edad y de escuela pública entre los 9 y los 14, momento en
el cual ingresó en la Universidad de Nebraska para, tres años más
tarde, comenzar a estudiar en la Universidad de
Harvard donde mostró interés
por la economíapero
se concentró en química, obteniendo su
bachillerato en 1896 y su doctorado en 1898. Desarrolló un intenso trabajo en cuestiones relativas
principalmente a esta disciplina, publicando numerosos artículos con los
resultados de sus investigaciones.
Murió a los 70 años de
un ataque cardíaco mientras se encontraba trabajando en su laboratorio en
Berkeley. Se le debe el estudio de los electrones periféricos de los átomos, del que dedujo, en 1916, una interpretación de la covalencia; propuso, en 1926, el nombre de fotón para el cuanto de
energía radiante.
La estructura
de Lewis
Esta representación se
usa para saber la cantidad de electrones de valencia de un elemento que
interactúan con otros o entre su misma especie, formando enlaces ya sea
simples, dobles, o triples y estos se encuentran íntimamente en relación con
los enlaces químicos entre las moléculas y su geometría molecular, y la
distancia que hay entre cada enlace formado.
Las estructuras de
Lewis muestran los diferentes átomos de una determinada molécula usando su
símbolo químico y líneas que se trazan entre los átomos que se unen entre sí.
En ocasiones, para representar cada enlace, se usan pares de puntos en vez de
líneas. Los electrones desapartados (los que no participan en los enlaces) se
representan mediante una línea o con un par de puntos, y se colocan alrededor
de los átomos a los que pertenece
Este modelo fue
propuesto por Gilbert N. Lewis quien lo introdujo por
primera vez en 1916 en su artículo La molécula y el átomo.
Producto 3: La simbología de los elementos y
formulas químicas
Un elemento químico es un tipo de materia constituida por átomos de la misma clase. En
su forma más simple posee un número determinado de protones en su núcleo, haciéndolo
pertenecer a una categoría única clasificada con el número atómico, aun cuando este
pueda desplegar distintas masas atómicas. Es un átomo con características
físicas únicas, aquella sustancia que no puede ser
descompuesta mediante una reacción química, en otras más
simples. No existen dos átomos de un mismo elemento con características
distintas y, en el caso de que estos posean número másico distinto, pertenecen
al mismo elemento pero en lo que se conoce como uno de sus isótopos. También es
importante diferenciar entre un «elemento químico» de una sustancia simple. Los elementos se
encuentran en la tabla periódica.
Algunos elementos se
han encontrado en la naturaleza y otros obtenidos de manera artificial,
formando parte de sustancias simples o de compuestos químicos. Otros han sido
creados artificialmente en los aceleradores de
partículas o en reactores atómicos. Estos últimos son
inestables y sólo existen durante milésimas de segundo. A lo largo de la
historia del universo se han ido generando la variedad de elementos químicos a
partir denucleosíntesis en varios procesos,
fundamentalmente debidos a estrellas.
La
mayoría de los símbolos de los elementos derivan de sus primitivos nombres
latinos, e incluso a los elementos más modernos, descubiertos en Estados Unidos
o en Europa, se les ha dado nombres de terminación latina, con un prefijo en
honor de algún científico o el lugar donde se descubrieron. Por ejemplo, el
berkelio, de símbolo Bk, se denomina en inglés berkelium, en honor de la
Universidad de Berkeley, en California, o el einstenio (Es), llamado así en
honor de Einstein.
Al
ser el español un idioma de raíz latina, la mayoría de los símbolos coinciden
con las iniciales del elemento. No obstante, hay determinados elementos cuyos
nombres latinos o griegos no coinciden con los españoles, y de ahí que haya
símbolos que no tienen relación con el nombre castellano del elemento.
|
Símbolo
|
Nombre
|
|
|
|
|
|
Año de
descubrimiento
|
Descubridor
|
|
Ac
|
|
89
|
227,0278
|
10,07
|
1047
|
3197
|
1899
|
Debierne 2-3
|
|
Ag
|
|
47
|
107,8682
|
10,49
|
961,9
|
2212
|
prehistórico
|
desconocido
|
|
Al
|
|
13
|
26,981539
|
2,70
|
660,5
|
2467
|
1825
|
Oersted
|
|
Am
|
|
95
|
243,0614
|
13,67
|
994
|
2607
|
1944
|
Seaborg
|
|
Ar
|
|
18
|
39,948
|
1,66 g/l
|
-189,4
|
-185,9
|
1894
|
Ramsay y Rayleigh
|
|
As
|
|
33
|
74,92159
|
5,72
|
613
|
613 (sublimiert)
|
ca. 1250
|
Albertus Magnus
|
|
At
|
|
85
|
209,9871
|
|
302
|
337
|
1940
|
Corson y MacKenzie
|
|
Au
|
|
79
|
196,96654
|
19,32
|
1064,4
|
2940
|
prehistórico
|
desconocido
|
|
B
|
|
5
|
10,811
|
2,46
|
2300
|
2550
|
1808
|
Davy y Gay-Lussac
|
|
Ba
|
|
56
|
137,327
|
3,65
|
725
|
1640
|
1808
|
Davy
|
|
Be
|
|
4
|
9,012182
|
1,85
|
1278
|
2970
|
1797
|
Vauquelin
|
|
Bh
|
|
107
|
262,1229
|
|
|
|
1976
|
Oganessian
|
|
Bi
|
|
83
|
208,98037
|
9,80
|
271,4
|
1560
|
1540
|
Agricola
|
|
Bk
|
|
97
|
247,0703
|
13,25
|
986
|
|
1949
|
Seaborg
|
|
Br
|
|
35
|
79,904
|
3,14
|
-7,3
|
58,8
|
1826
|
Balard
|
|
C
|
|
6
|
12,011
|
3,51
|
3550
|
4827
|
prehistórico
|
desconocido
|
|
Ca
|
|
20
|
40,078
|
1,54
|
839
|
1487
|
1808
|
Davy
|
|
Cd
|
|
48
|
112,411
|
8,64
|
321
|
765
|
1817
|
Stromeyer y Hermann
|
|
Ce
|
|
58
|
140,115
|
6,77
|
798
|
3257
|
1803
|
von Hisinger y Berzelius
|
|
Cf
|
|
98
|
251,0796
|
15,1
|
900
|
|
1950
|
Seaborg
|
|
Cl
|
|
17
|
35,4527
|
2,95 g/l
|
-101
|
-34,6
|
1774
|
Scheele
|
|
Cm
|
|
96
|
247,0703
|
13,51
|
1340
|
|
1944
|
Seaborg
|
|
Cn
|
|
112
|
277
|
|
|
|
1996
|
Society for
Heavy Ion Research
|
|
Co
|
|
27
|
58,9332
|
8,89
|
1495
|
2870
|
1735
|
Brandt
|
|
Cr
|
|
24
|
51,9961
|
7,14
|
1857
|
2482
|
1797
|
Vauquelin
|
|
Cs
|
|
55
|
132,90543
|
1,90
|
28,4
|
690
|
1860
|
Kirchhoff y Bunsen
|
|
Cu
|
|
29
|
63,546
|
8,92
|
1083,5
|
2595
|
prehistórico
|
desconocido
|
|
Db
|
|
105
|
262,1138
|
|
|
|
1967/70
|
Flerow oder Ghiorso
|
|
Ds
|
|
110
|
269
|
|
|
|
1994
|
Society for
Heavy Ion Research
|
|
Dy
|
|
66
|
162,5
|
8,56
|
1409
|
2335
|
1886
|
Lecoq de Boisbaudran
|
|
Er
|
|
68
|
167,26
|
9,05
|
1522
|
2510
|
1842
|
Mosander
|
|
Es
|
|
99
|
252,0829
|
|
860
|
|
1952
|
Seaborg
|
|
Eu
|
|
63
|
151,965
|
5,25
|
822
|
1597
|
1901
|
Demaçay
|
|
F
|
|
9
|
18,9984032
|
1,58 g/l
|
-219,6
|
-188,1
|
1886
|
Moissan
|
|
Fe
|
|
26
|
55,847
|
7,87
|
1535
|
2750
|
prehistórico
|
desconocido
|
|
Fl
|
|
114
|
|
|
|
|
|
|
|
Fm
|
|
100
|
257,0951
|
|
|
|
1952
|
Seaborg
|
|
Fr
|
|
87
|
223,0197
|
|
27
|
677
|
1939
|
Perey
|
|
Ga
|
|
31
|
69,723
|
5,91
|
29,8
|
2403
|
1875
|
Lecoq de Boiskaudran
|
|
Gd
|
|
64
|
157,25
|
7,89
|
1311
|
3233
|
1880
|
de Marignac
|
|
Ge
|
|
32
|
72,61
|
5,32
|
937,4
|
2830
|
1886
|
Winkler
|
|
H
|
|
1
|
1,00794
|
0,084 g/l
|
-259,1
|
-252,9
|
1766
|
Cavendish
|
|
He
|
|
2
|
4,002602
|
0,17 g/l
|
-272,2
|
-268,9
|
1895
|
Janssen, Ramsay y Cleve
|
|
Hf
|
|
72
|
178,49
|
13,31
|
2150
|
5400
|
1923
|
Coster y vón Hevesy
|
|
Hg
|
|
80
|
200,59
|
13,55
|
-38,9
|
356,6
|
prehistórico
|
desconocido
|
|
Ho
|
|
67
|
164,93032
|
8,78
|
1470
|
2720
|
1878
|
Soret
|
|
Hs
|
|
108
|
265
|
|
|
|
1984
|
Society for
Heavy Ion Research
|
|
I
|
|
53
|
126,90447
|
4,94
|
113,5
|
184,4
|
1811
|
Courtois
|
|
In
|
|
49
|
114,82
|
7,31
|
156,2
|
2080
|
1863
|
Reich y Richter
|
|
Ir
|
|
77
|
192,22
|
22,65
|
2410
|
4130
|
1803
|
Tenant y andere
|
|
K
|
|
19
|
39,0983
|
0,86
|
63,7
|
774
|
1807
|
Davy
|
|
Kr
|
|
36
|
83,8
|
3,48 g/l
|
-156,6
|
-152,3
|
1898
|
Ramsay y Travers
|
|
La
|
|
57
|
138,9055
|
6,16
|
920
|
3454
|
1839
|
Mosander
|
|
Li
|
|
3
|
6,941
|
0,53
|
180,5
|
1317
|
1817
|
Arfvedson
|
|
Lr
|
|
103
|
260,1053
|
|
|
|
1961
|
Ghiorso
|
|
Lu
|
|
71
|
174,967
|
9,84
|
1656
|
3315
|
1907
|
Urbain
|
|
Lv
|
|
116
|
|
|
|
|
|
|
|
Md
|
|
101
|
258,0986
|
|
|
|
1955
|
Seaborg
|
|
Mg
|
|
12
|
24,305
|
1,74
|
648,8
|
1107
|
1755
|
Black
|
|
Mn
|
|
25
|
54,93805
|
7,44
|
1244
|
2097
|
1774
|
Gahn
|
|
Mo
|
|
42
|
95,94
|
10,28
|
2617
|
5560
|
1778
|
Scheele
|
|
Mt
|
|
109
|
266
|
|
|
|
1982
|
Society for
Heavy Ion Research
|
|
N
|
|
7
|
14,00674
|
1,17 g/l
|
-209,9
|
-195,8
|
1772
|
Rutherford
|
|
Na
|
|
11
|
22,989768
|
0,97
|
97,8
|
892
|
1807
|
Davy
|
|
Nb
|
|
41
|
92,90638
|
8,58
|
2468
|
4927
|
1801
|
Hatchet
|
|
Nd
|
|
60
|
144,24
|
7,00
|
1010
|
3127
|
1895
|
von Welsbach
|
|
Ne
|
|
10
|
20,1797
|
0,84 g/l
|
-248,7
|
-246,1
|
1898
|
Ramsay y Travers
|
|
Ni
|
|
28
|
58,69
|
8,91
|
1453
|
2732
|
1751
|
Cronstedt
|
|
No
|
|
102
|
259,1009
|
|
|
|
1958
|
Seaborg
|
|
Np
|
|
93
|
237,0482
|
20,48
|
640
|
3902
|
1940
|
McMillan y Abelson
|
|
O
|
|
8
|
15,9994
|
1,33 g/l
|
-218,4
|
-182,9
|
1774
|
Priestley y Scheele
|
|
Os
|
|
76
|
190,2
|
22,61
|
3045
|
5027
|
1803
|
Tenant
|
|
P
|
|
15
|
30,973762
|
1,82
|
44 (P4)
|
280 (P4)
|
1669
|
Brandt
|
|
Pa
|
|
91
|
231,0359
|
15,37
|
1554
|
4030
|
1917
|
Soddy, Cranston y Hahn
|
|
Pb
|
|
82
|
207,2
|
11,34
|
327,5
|
1740
|
prehistórico
|
desconocido
|
|
Pd
|
|
46
|
106,42
|
12,02
|
1552
|
3140
|
1803
|
Wollaston
|
|
Pm
|
|
61
|
146,9151
|
7,22
|
1080
|
2730
|
1945
|
Marinsky y Glendenin
|
|
Po
|
|
84
|
208,9824
|
9,20
|
254
|
962
|
1898
|
Marie y Pierre Curie
|
|
Pr
|
|
59
|
140,90765
|
6,48
|
931
|
3212
|
1895
|
von Welsbach
|
|
Pt
|
|
78
|
195,08
|
21,45
|
1772
|
3827
|
1557
|
Scaliger
|
|
Pu
|
|
94
|
244,0642
|
19,74
|
641
|
3327
|
1940
|
Seaborg
|
|
Ra
|
|
88
|
226,0254
|
5,50
|
700
|
1140
|
1898
|
Marie y Pierre Curie
|
|
Rb
|
|
37
|
85,4678
|
1,53
|
39
|
688
|
1861
|
Bunsen y Kirchhoff
|
|
Re
|
|
75
|
186,207
|
21,03
|
3180
|
5627
|
1925
|
Noddack, Tacke y Berg
|
|
Rf
|
|
104
|
261,1087
|
|
|
|
1964/69
|
Flerow oder Ghiorso
|
|
Rg
|
|
111
|
272
|
|
|
|
1994
|
Society for
Heavy Ion Research
|
|
Rh
|
|
45
|
102,9055
|
12,41
|
1966
|
3727
|
1803
|
Wollaston
|
|
Rn
|
|
86
|
222,0176
|
9,23 g/l
|
-71
|
-61,8
|
1900
|
Dorn
|
|
Ru
|
|
44
|
101,07
|
12,45
|
2310
|
3900
|
1844
|
Claus
|
|
S
|
|
16
|
32,066
|
2,06
|
113
|
444,7
|
prehistórico
|
desconocido
|
|
Sb
|
|
51
|
121,75
|
6,69
|
630,7
|
1750
|
prehistórico
|
desconocido
|
|
Sc
|
|
21
|
44,95591
|
2,99
|
1539
|
2832
|
1879
|
Nilson
|
|
Se
|
|
34
|
78,96
|
4,82
|
217
|
685
|
1817
|
Berzelius
|
|
Sg
|
|
106
|
263,1182
|
|
|
|
1974
|
Oganessian
|
|
Si
|
|
14
|
28,0855
|
2,33
|
1410
|
2355
|
1824
|
Berzelius
|
|
Sm
|
|
62
|
150,36
|
7,54
|
1072
|
1778
|
1879
|
Lecoq de Boisbaudran
|
|
Sn
|
|
50
|
118,71
|
7,29
|
232
|
2270
|
prehistórico
|
desconocido
|
|
Sr
|
|
38
|
87,62
|
2,63
|
769
|
1384
|
1790
|
Crawford
|
|
Ta
|
|
73
|
180,9479
|
16,68
|
2996
|
5425
|
1802
|
Ekeberg
|
|
Tb
|
|
65
|
158,92534
|
8,25
|
1360
|
3041
|
1843
|
Mosander
|
|
Tc
|
|
43
|
98,9063
|
11,49
|
2172
|
5030
|
1937
|
Perrier y Segrè
|
|
Te
|
|
52
|
127,6
|
6,25
|
449,6
|
990
|
1782
|
von Reichenstein
|
|
Th
|
|
90
|
232,0381
|
11,72
|
1750
|
4787
|
1829
|
Berzelius
|
|
Ti
|
|
22
|
47,88
|
4,51
|
1660
|
3260
|
1791
|
Gregor y Klaproth
|
|
Tl
|
|
81
|
204,3833
|
11,85
|
303,6
|
1457
|
1861
|
Crookes
|
|
Tm
|
|
69
|
168,93421
|
9,32
|
1545
|
1727
|
1879
|
Cleve
|
|
U
|
|
92
|
238,0289
|
18,97
|
1132,4
|
3818
|
1789
|
Klaproth
|
|
Uuo
|
|
118
|
|
|
|
|
|
|
|
Uup
|
|
115
|
|
|
|
|
|
|
|
Uus
|
|
117
|
|
|
|
|
|
|
|
Uut
|
|
113
|
|
|
|
|
|
|
|
V
|
|
23
|
50,9415
|
6,09
|
1890
|
3380
|
1801
|
del Rio
|
|
W
|
|
74
|
183,85
|
19,26
|
3407
|
5927
|
1783
|
Hermanos Elhuyar
|
|
Xe
|
|
54
|
131,29
|
4,49 g/l
|
-111,9
|
-107
|
1898
|
Ramsay y Travers
|
|
Y
|
|
39
|
88,90585
|
4,47
|
1523
|
3337
|
1794
|
Gadolin
|
|
Yb
|
|
70
|
173,04
|
6,97
|
824
|
1193
|
1878
|
de Marignac
|
|
Zn
|
|
30
|
65,39
|
7,14
|
419,6
|
907
|
prehistórico
|
desconocido
|
|
Zr
|
|
40
|
91,224
|
6,51
|
1852
|
4377
|
1789
|
Klaproth
|
Producto
4: Teoría de la neutralización del átomo
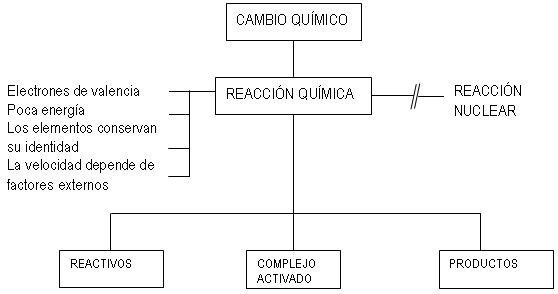
Una reacción
de neutralización es una reacción entre un ácido y una base. Cuando en la reacción participan un ácido fuerte
y una base fuerte se obtiene sal neutra y agua.
Mientras que si una de las especies es de naturaleza débil se obtiene su
respectiva especie conjugada y agua. Así pues, se puede decir que la
neutralización es la combinación de cationes hidrógeno y de aniones hidróxido para formar moléculas de agua. Durante este proceso se forma una
sal. Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma
de calor.
Generalmente la siguiente reacción ocurre:
ácido + base → sal
haloidea + agua
Este tipo de reacciones son especialmente útiles
como técnicas de análisis cuantitativo. En este caso se puede usar una solución indicadora para conocer el punto en el que se
ha alcanzado la neutralización completa. Algunos indicadores son la fenolftaleína (si los elementos a neutralizar son ácido clorhídrico e hidróxido de sodio), azul de safranina, el azul de metileno, etc. Existen también métodos electroquímicos para
lograr este propósito como el uso de un pHmetro o
la conductimétria.
- Cuando la neutralización se produce entre una
base fuerte y un ácido débil. El anillo del ácido sufre una hidrólisis
produciéndose iones hidróxido, por lo que el pH es > 7.
- Cuando la neutralización se produce entre una
base débil y un ácido débil. El anión del ácido sufre una hidrólisis al igual
que el catión de la base, por lo que el pH es < 7 si es más débil la base y
es >7 si es más débil el ácido.
La elección del indicador adecuado para determinar
el punto de equivalencia dependerá del pH final, que tiene que estar dentro del
intervalo en el que el indicador sufre el cambio de color.
Ejemplos:
Hidróxido de sodio mas ácido carbónico que forma
carbonato de sodio mas agua:
·
Ácido nítrico mas hidróxido de aluminio que forma
nitrato de aluminio mas agua:
·
Neutralización En un matraz ponemos una disolución
de ácido clorhídrico y añadimos unas gotas del indicador fenolftaleína. La
fenolftaleína es un indicador que en medio ácido es incoloro, mientras que en
medio básico adquiere un color rosa. En principio la disolución es ácida e
incolora.
Ahora colocamos en una bureta una disolución de
hidróxido de sodio y la abrimos un poco. A medida que cae hidróxido de sodio,
éste va reaccionando con el ácido clorhídrico para formar cloruro de sodio y
agua, con lo que la concentración del ácido disminuye y el pH aumenta. Cuando
se ha consumido todo el ácido, la siguiente gota de base que se añade vuelve a
la disolución básica, y el indicador cambia al color rosa. En ese momento
sabemos que todo el ácido ha sido neutralizado.eso es neutralizacion
Las neutralizaciones se producen de
"equivalente a equivalente". Un equivalente gramo es igual a la masa
molar dividida la carga del ión por lo tanto M (molaridad)/carga del ión=N
(normalidad). La fórmula que permite calcular volúmenes necesarios para
neutralizar una sustancia es N1 x v1= N2x V2.
Producto 5: Clasificación de
moléculas y átomos
Produto 6: “Aportaciones de Canizzaro Y
Mendeleyev”
Método de Cannizzaro
Dado que los átomos son indivisibles, en una
molécula debe haber necesariamente un número entero, y casi siempre sencillo,
de átomos de cada clase. Si se determina el peso molecular de los compuestos de
un elemento y el porcentaje en que entra este elemento en cada uno de los
compuestos, las cantidades halladas son múltiplos sencillos del peso atómico
del elemento.
Fue Cannizzaro quien determinó que un mol de gas
ocupaba un volumen de 22,4 L en condiciones normales (c.n.). Su método permitió
determinar la masa atómica relativa de algunos elementos.
Compuestos de carbono Compuesto Masa de 22,4 L %
de carbono Masa de C Nº de at. de C en 1 molécula
A 58 62,1 % 36 36 / 12 = 3
B 16 75,0 % 12 12 / 12 = 1
C 46 52,2 % 24 24 / 12 = 2
D 30 40,0 % 12 12 / 12 = 1
E 26 92,3 % 24 24 / 12 = 2
En la tabla se muestra como ejemplo de la
utilización de este método para varios compuestos de carbono (A = acetona; B =
metano; C = etanol; D = formaldehído; E = acetileno).
A partir del dato del volumen molar (22,4 L de
compuesto) Cannizzaro averiguaba la masa molecular de un determinado compuesto
gaseoso del elemento (p. el carbono), como se muestra en la segunda columna de
la tabla.
A continuación se hacía un análisis elemental de
cada compuesto, hallando el porcentaje del elemento en cada uno de los
compuestos analizados (segunda columna).
Finalmente se calculaba la masa del elemento en
la masa molecular de cada compuesto (haciendo el producto de los datos
contenidos en la columna segunda y tercera).
La masa así calculada debe ser la masa atómica
(si en el compuesto entra un sólo átomo de carbono por molécula) o un múltiplo
entero de éste si entra más de uno.
Si se elige un número suficiente de compuestos,
es muy probable que al menos uno de ellos contenga un sólo átomo por molécula
de compuesto, de este modo la masa atómica debe ser el valor más bajo (es
decir, el máximo común divisor de todos los valores obtenidos). Por ello este
método se conoce también como método del máximo común divisor.
Método
Dmitri Mendeléyev
Químico ruso, creador de la Tabla periódica de
los elementos.
Sobre las bases del análisis espectral
establecido por Bunsen y Kirchoff se ocupó de problemas químico-físicos
relacionados con el espectro de emisión de los elementos. Realizó las determinaciones
de volúmenes específicos y analizó las condiciones de licuefacción de los
gases, así como también el origen de los petróleos.
Su investigación principal fue la que dio origen
a la enunciación de la ley periódica de los elementos base del sistema
periódico que lleva su nombre. En 1869 publicó su libro Principios de la
química, en el que desarrollaba la teoría de la Tabla periódica de los
elementos. El día 2 de febrero de 2007 se cumplió un centenario de su muerte.
El gran éxito de Mendeléyev, la tabla periódica
y la predicción de elementos no descubiertos aún en 1891
Dmitri Ivánovich Mendeléiev nació en Tobolsk
(Siberia) el 8 de febrero de 1834. Era el menor de al menos 17 hermanos. En el
mismo año en que nació, su padre quedó ciego perdiendo así su trabajo (era el
director del colegio del pueblo). Recibían una pensión insuficiente por lo que
la madre tuvo que tomar las riendas de la familia y dirigir la fábrica de
cristal que había fundado su abuelo. Desde joven se destacó en Ciencias en la escuela,
no así en ortografía. Un cuñado suyo exiliado por motivos políticos y un
químico de la fabrica le inculcaron el amor por las ciencias.
La familia sufrió ya que nada más terminar
Dmitri el bachiller, murió su padre y se quemó la fábrica de cristal que
dirigía su madre. La madre apostó por invertir en la educación de Dmitri los
ahorros guardados en vez de reconstruir la fábrica. En esa época la mayoría de
los hermanos, excepto una hermana, se habían independizado, y la madre se los
llevó a Moscú para que Dmitri ingresase en la universidad, pero no fue
admitido. Quizá debido al clima político que existía en ese momento en Rusia,
ya que no admitían en la universidad a nadie que no fuese de Moscú.
Producto 7: “Breve historia de la tabla
periódica”
La tabla periódica de los elementos clasifica, organiza y distribuye
los distintos elementos químicos, conforme a sus propiedades y
características; su función principal es establecer un orden específico
agrupando elementos.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos
basándose en las propiedades químicas de los elementos, si bien Julius Lothar Meyer, trabajando por separado,
llevó a cabo un ordenamiento a partir de las propiedades
físicas de los átomos. La forma actual es una versión modificada de
la de Mendeléyev; fue diseñada por Alfred Werner.
La historia de la tabla periódica
está íntimamente relacionada con varios aspectos del desarrollo de la química y
la física:
·
El
estudio de las propiedades comunes y la clasificación de los elementos.
·
Las
relaciones entre la masa atómica (y, más adelante, el número atómico) y las
propiedades periódicas de los elementos.
Aunque algunos elementos como
el oro (Au), plata (Ag), cobre (Cu), plomo (Pb)
y elmercurio (Hg) ya eran conocidos
desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió
en el siglo XVII cuando el alquimista Henning Brand descubrió
elfósforo (P). 2 En el siglo XVIII se conocieron numerosos
nuevos elementos, los más importantes de los cuales fueron los gases, con el
desarrollo de la química neumática:oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la
nueva concepción de elemento, que condujo a Antoine
Lavoisier a escribir su famosa lista de sustancias simples,
donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la
pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de
nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo
gracias a los trabajos de Humphry Davy.
En 1830 ya se conocían 55 elementos. Posteriormente,
a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos
nombrados por el color de sus líneas espectrales características: cesio (Cs,
del latín caesĭus,
azul), talio (Tl, de tallo, por su color verde),rubidio (Rb, rojo), etc.
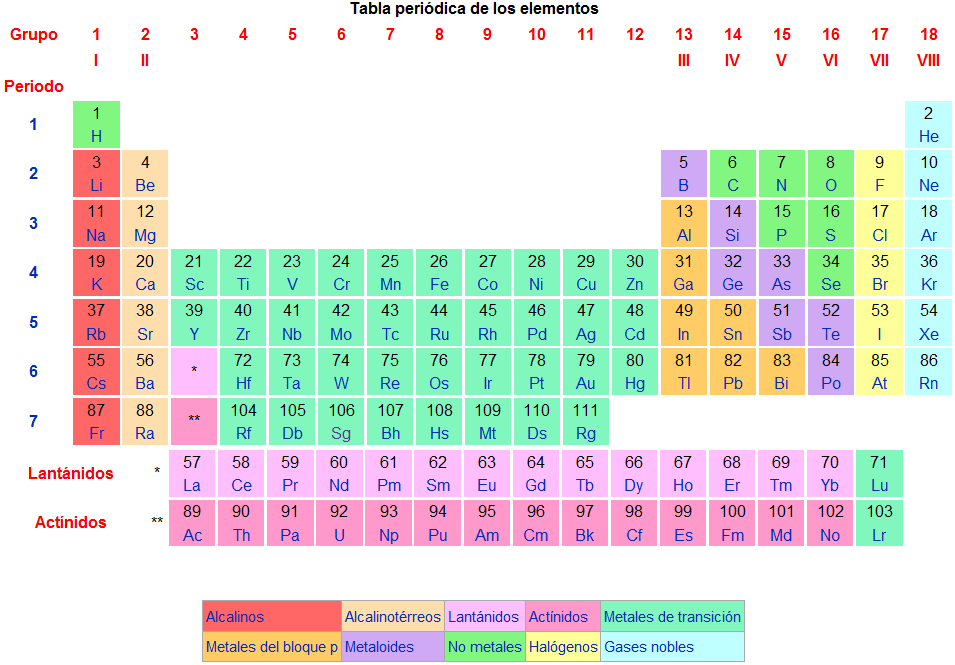
Producto 8 “Características de la
tabla periódica”
Producto
9: Mapa conceptual de un Enlace
Producto
10: Mapa conceptual de electrolitos, ionización y disociación
Producto
11: Opinión del tema los metales para el ser humano
Ciertos elementos químicos conocidos metálicos
tienen gran importancia en los organismos vivos:
Plantas, animales, hongos y bacterias. Pese a parecer imposible que la vida y
el metal se lleven bien, muchos
metales son imprescindibles para la vida. Sucede que los metales no se
encuentran como tales cuando constituyen parte del metabolismo de un ser vivo,
se encuentran en forma de cationes disueltos en los líquidos corporales o
unidos a proteínas plasmáticas o estructurales.
Son 30 los elementos químicos que se consideran
esenciales para la vida.De estos 30 elementos, 17 son metales, 4 son semi metales y el resto
son no metales.
Los 17
metales considerados esenciales para la vida son:
Sodio (Na),
Potasio (K), Magnesio (Mg), Calcio (Ca), Mn (Mn), Hierro(Fe), Zinc (Zn),
Cadmio (Cd), Cromo (Cr), Cobre (Cu) Niquel (Ni), Estroncio (Sr), Bario (Ba),
Vanadio (V), Molibdeno (Mo), Cobalto (Co) y Estaño (Sn)


.jpg)
.jpg)














